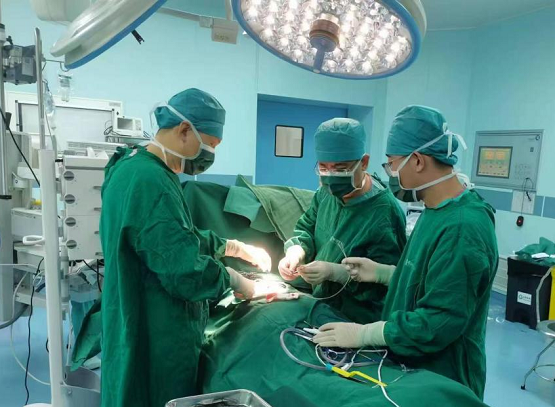
康諾亞公布2024年業(yè)績:加速進階,全面邁入商業(yè)化新階段
成都2025年3月24日 /美通社/ -- 康諾亞(香港聯交所代碼:02162)發(fā)布2024年業(yè)績報告,2024年康諾亞多項創(chuàng)新成果落地,商業(yè)化全面推進,加速向綜合性生物制藥公司跨越轉型。
康諾亞董事長兼首席執(zhí)行官陳博博士表示,"過去一年,康諾亞實現重要突破,康悅達?(司普奇拜單抗)成人中重度特應性皮炎、慢性鼻竇炎伴鼻息肉、季節(jié)性過敏性鼻炎三項適應癥獲批上市,以國產創(chuàng)新開啟治療新時代;各項高潛力管線取得重要進展,多個創(chuàng)新成果發(fā)表于國際頂級期刊。公司獲全球知名投資機構支持,以NewCo創(chuàng)新模式四度出海,讓自主創(chuàng)新產品登上國際舞臺。人才團隊不斷壯大,生產基地建設快速推進,生產能力持續(xù)升級,為公司新階段發(fā)展奠定基礎。2025年,將是我們全面建立自身免疫性疾病等創(chuàng)新療法領先優(yōu)勢的關鍵之年,我們將繼續(xù)推進差異化臨床研發(fā),加速免疫療法的創(chuàng)新迭代,促進重點產品臨床價值的深度挖掘,加速患者創(chuàng)新藥物可及性,驅動公司長期、穩(wěn)健、高質量發(fā)展。"

康悅達司普奇拜單抗
核心產品進展及研發(fā)管線亮點
康悅達?(司普奇拜單抗,IL-4Rα抗體)
三項適應癥獲批上市
截止2024年底,3個半月內實現銷售收入人民幣約4,000萬元
2024年9月,康悅達?(司普奇拜單抗)治療成人中重度特應性皮炎的藥品上市許可申請獲國家藥監(jiān)局批準,成為國內首個自主研發(fā)、全球唯二獲批上市的IL-4Rα抗體藥物,開啟特應性皮炎治療EASI-90新時達。臨床研究顯示,康悅達?(司普奇拜單抗)首劑快速起效,24小時快速緩解瘙癢,頭頸部應答更快更強,2周實現各部位皮損一致全面獲益;單藥52周,"雙9可達": EASI-75應答率高達92.5%,EASI-90應答率高達77.1%;單藥52周復發(fā)率僅為0.9%,結膜炎發(fā)生率僅5.3%,能夠持續(xù)緩解瘙癢,實現無癢緩解。
2024年12月,康悅達?(司普奇拜單抗)治療慢性鼻竇炎伴鼻息肉的藥品上市許可申請獲國家藥監(jiān)局批準,成為目前國內首個批準用于治療慢性鼻竇炎伴鼻息肉的生物制劑。臨床研究顯示,康悅達?(司普奇拜單抗)首次用藥2周后,72%患者鼻息肉顯著縮小,24%患者實現鼻腔通氣;用藥4周后,嗅覺明顯恢復,42%患者實現鼻腔通氣,46%患者恢復嗅覺;治療24周,81%的患者鼻息肉大小減半(NPS評分較基線改善≥2分),70%的患者實現鼻腔通氣(NCS評分較基線改善≥1分);治療52周,90%的患者鼻息肉大小減半,86%的患者實現鼻腔通氣。
2025年2月,康悅達?(司普奇拜單抗)治療季節(jié)性過敏性鼻炎的藥品上市許可申請獲國家藥監(jiān)局批準,成為全球唯一獲批治療季節(jié)性過敏性鼻炎IL-4Rα生物制劑。臨床研究顯示,首次用藥2天后,鼻塞癥狀快速緩解;4天后,52%患者實現鼻腔通氣。第一次治療后,42%患者達到輕度甚至完全緩解狀態(tài)。第二次治療后,88%患者眼部癥狀達到輕度甚至完全緩解狀態(tài)。
2024年2月,啟動治療青少年中重度特應性皮炎的Ⅲ期臨床研究。
2024年5月,啟動治療結節(jié)性癢疹的III期臨床研究,目前正在進行患者入組工作。
2024年6月,治療中重度特應性皮炎的III期臨床試驗長期療效及安全性數據在2024年歐洲過敏及臨床免疫學會(EAACI)年會上以口頭報告形式發(fā)布。
2024年10月,司普奇拜單抗注射液治療成人中重度特應性皮炎的III期臨床研究52周療效與安全性數據全文發(fā)表于國際過敏與免疫學領域頂級期刊《Allergy》。
CMG901/AZD0901(Claudin 18.2抗體偶聯藥物)
FDA快速通道資格認證、CDE突破性治療藥物認定
AstraZeneca就CMG901(AZD0901)治療晚期實體瘤開展了多項全球多中心臨床研究,包括治療2L+胃癌的臨床III期、1L胃癌的臨床II期、1L胰腺癌的臨床II期及2L+膽道癌的臨床II期研究。
2024年6月,CMG901(AZD0901)治療晚期胃癌/胃食管結合部腺癌的I期臨床研究最新數據在2024年美國臨床腫瘤學會(ASCO)年會上以口頭報告形式發(fā)布。2025年1月6日,該臨床I期數據在國際權威腫瘤學期刊《The Lancet Oncology》上發(fā)表。研究結果顯示,所有93例Claudin 18.2高表達胃癌/胃食管結合部腺癌受試者的中位無進展期(mPFS)為4.8個月,中位總生存期(mOS)為11.8個月。
CM313(CD38抗體)
啟動并推動CM313治療復發(fā)/難治性多發(fā)性骨髓瘤的I/II期臨床研究。
2024年6月,CM313治療成人原發(fā)免疫性血小板減少癥的研究成果發(fā)表在《新英格蘭醫(yī)學雜志》。研究顯示,其對難治性免疫性血小板減少癥患者的治療應答率高達95%,表現出快速且持續(xù)的療效反應,且安全性良好。
2024年7月,完成CM313治療系統性紅斑狼瘡的Ib/IIa期臨床研究,并計劃于2025年上半年啟動II期臨床研究。
啟動并推進CM313治療原發(fā)免疫性血小板減少癥的II期臨床研究,正在進行患者入組工作,首例患者已于2024年11月完成入組及給藥。
2025年初啟動并推進CM313治療IgA腎病的II期臨床研究,目前正在進行患者入組的準備工作。
CM512(TSLPxIL-13雙特異性抗體)
啟動并推進CM512治療中重度特應性皮炎的I期臨床研究,首列受試者已于2024年9月完成入組。已于2025年一季度,啟動海外治療哮喘的臨床I期研究。
CM336(BCMA x CD3 雙抗)
持續(xù)推進CM336治療復發(fā)或難治性多發(fā)性骨髓瘤的I/II期臨床研究,目前處于劑量擴展階段。
2024年12月,第66屆美國血液學會(ASH)年會以墻報形式公布了CM336治療復發(fā)或難治性多發(fā)性骨髓瘤的I/II期臨床研究的最新數據。
CM383(Aβ原細纖維絲抗體)
完成CM383 Ia期臨床研究,全部受試者已出組。
2024年11月,CM383治療阿爾茨海默病源性輕度認知功能障礙和輕度阿爾茨海默病的 Ib 期臨床研究完成首例受試者入組。
CM518D1(CDH17 ADC)
已向CDE遞交CM518D1臨床試驗申請,并計劃開展治療晚期實體瘤I/II期臨床試驗。
CM355/ICP-B02(CD20 x CD3 雙抗)
持續(xù)推進CM355治療復發(fā)/難治性非霍奇金淋巴瘤的I/II期臨床研究,初步數據均顯示CM355對于濾泡性淋巴瘤(FL)與彌漫性大B細胞淋巴瘤(DLBCL)患者具有良好的療效。
CM350(GPC3 x CD3 雙抗)
持續(xù)推進CM350治療晚期實體瘤I/II期臨床研究,目前處于I/II期臨床研究的劑量遞增階段,已觀測到初步的積極療效。
CM369 /ICP-B05C(CCR8抗體)
持續(xù)推進CM369治療晚期實體瘤及復發(fā)/難治性非霍奇金淋巴瘤的I期臨床研究。
CM380(GPRC5D x CD3雙特異性抗體)
正在計劃開展CM380治療復發(fā)或難治性多發(fā)性骨髓瘤患者的I/II期臨床研究。
財務及公司運營重點
積極探索多元化BD模式,最大化管線全球價值
2024年7月,康諾亞與世界級醫(yī)療保健基金OrbiMed合作,共同成立Belenos Biosciences, Inc.,授予Belenos在全球(不包括中國內地、香港、澳門及臺灣地區(qū))開發(fā),生產及商業(yè)化CM512及CM536(兩款雙抗新藥)的獨家權利。康諾亞作為主要股東持股 30%。
2024年11月,康諾亞與Platina Medicines Ltd (PML)訂立獨家許可協議,授予PML在全球(不包括中國內地、香港、澳門及臺灣地區(qū))研究、開發(fā)、生產、注冊及商業(yè)化CM336的獨家權利。PML母公司Ouro Medicines(擁有PML全部股權)由GSK和Monograph Capital孵化。
2025年1月,康諾亞與Timberlyne Therapeutics, Inc.訂立獨家對外許可協議,授予Timberlyne在全球(不包括中國內地、香港、澳門及臺灣)開發(fā)、生產及商業(yè)化CM313的獨家權利。Timberlyne為公司與生物醫(yī)藥行業(yè)知名基金貝恩資本、Abingworth、Venrock共同創(chuàng)立,A輪融資1.8億美金,康諾亞為Timberlyne最大股東,擁有其25.79%的股權。
2025年1月,康諾亞、北京諾誠健華及雙方合資公司共同與Prolium Biosciences就CM355的開發(fā)及商業(yè)化訂立協議,授予Prolium在全球非腫瘤適應癥以及亞洲以外地區(qū)腫瘤適應癥方面開發(fā)、注冊、生產及商業(yè)化CM355的獨家權利。Prolium為公司與生物醫(yī)藥知名機構RTW聯合創(chuàng)立。
人員團隊持續(xù)壯大,自主產能加速提升
目前,康諾亞已有員工約1300人,其中商業(yè)化團隊240余人,藥物發(fā)現及臨床運營近400人。康諾亞將持續(xù)吸納人才,以支持不斷增長的產品商業(yè)化銷售、研發(fā)、臨床、生產及公司運營需求。
康諾亞成都生產基地產能持續(xù)提升,現有總產能約20,000升,以保障后續(xù)包括司普奇拜單抗在內的多條管線臨床用藥及商業(yè)化放量,生產基地所有設計均符合國家藥監(jiān)局、美國FDA、歐盟EMA的cGMP規(guī)定。

康諾亞成都生產基地
財務數據
截止2024年12月31日,康諾亞全年收入總計人民幣4.3億元,同比增長21%。其中包括康悅達?(司普奇拜單抗)3個半月銷售收入人民幣0.4億元和授權合作的收入人民幣3.9億元。2024年,公司繼續(xù)推進差異化管線研發(fā)及臨床研究,研發(fā)支出約人民幣7.3億元,同比增長23%。公司在手現金合計約人民幣21億元。
未來,康諾亞將不斷開拓、搭建、完善技術平臺,繼續(xù)在中國及全球迅速推進候選管線的研發(fā)進展,全面推進已上市產品及適應癥的商業(yè)化進程。同時,康諾亞還將在中國及全球范圍內積極探索建立戰(zhàn)略伙伴關系,以多種形式加快候選藥物惠及全球患者。康諾亞計劃進一步招募商業(yè)化銷售、臨床開發(fā)及生產的優(yōu)秀人才,擴大符合cGMP要求的生產能力,降低成本、提高效益,不斷致力于為患者開發(fā)、生產及商業(yè)化更具世界范圍競爭力、高質量、可負擔的創(chuàng)新藥物。